Pět let od svého zavedení zásadním způsobem mění Nařízení EU o zdravotnických prostředcích 2017/745 (Medical Device Regulation, MDR) proces uvádění zdravotnických a dentálních prostředků na trh v Evropě. Kritici však upozorňují na to, že regulace neúmyslně oslabuje právě ty oblasti, které měla chránit – bezpečnost zdravotnických prostředků a konkurenceschopnost inovativního evropského průmyslu. Nová zpráva připravená zástupci odvětví identifikuje hlavní nedostatky MDR a navrhuje konkrétní možnosti jejich řešení.
Podle zprávy s názvem Zajištění bezpečnosti dodávek v Evropě a evropské konkurenceschopnosti přišlo Německo od roku 2014 o více než 10 000 převážně malých výrobců zdravotnických prostředků. Tyto podniky sice představují přibližně 99 % všech výrobců na trhu, jejich podíl na celkovém obratu však klesl z přibližně 75 % na něco málo přes 36 %. Zpráva dále konstatuje, že řada menších výrobců byla nucena ukončit činnost nebo zcela opustit sektor, zatímco větší společnosti přistoupily k ukončení méně rentabilních produktových řad.
Pro stomatologické praxe se tento vývoj promítá do postupného mizení dentálních materiálů, omezení dostupného sortimentu a zvýšeného rizika výpadků v léčbě v situacích, kdy dlouhodobě používané výrobky přestávají být na trhu dostupné. Autoři zdůrazňují, že tento trend se začal projevovat již před pandemií COVID-19 a úzce souvisí s požadavky na přecertifikaci výrobků podle MDR.
V rámci MDR kontrolují notifikované osoby u velkých výrobců pouze reprezentativní vzorek technické dokumentace, zatímco malé a střední podniky s omezeným portfoliem výrobků často čelí kompletní přecertifikaci všech produktů v jednom certifikačním cyklu. V některých případech je stejný technický spis přezkoumáván opakovaně každý rok, vždy za plné náklady. Zátěž v podobě auditního času přepočteného na jednoho zaměstnance je u menších podniků výrazně vyšší. Zpráva v této souvislosti uvádí příklad společnosti Dentaurum, dentální firmy založené v jihozápadním Německu v roce 1886, která byla nucena stáhnout z nabídky přibližně 1 000 výrobků v důsledku požadavků MDR.
Yvonne Hoffmann, členka vedení společnosti Hoffmann Dental Manufaktur a spoluautorka zprávy, upozornila, že její firma vyřadila ze svého portfolia přípravek Proxifungine. Prodej tohoto dlouhodobě zavedeného zdravotnického prostředku třídy III byl ukončen z důvodu vysokých nákladů na jeho opětovnou registraci. „Další výrobky mohou následovat po skončení přechodného období na konci roku 2028,“ uvedla Hoffmann v rozhovoru pro Dental Tribune International. U skutečně malých podniků je podle ní volba často zásadní: buď ukončit činnost, nebo opustit oblast zdravotnických prostředků a přejít do méně regulovaného segmentu.
Zpráva rovněž upozorňuje na nedostatečné nastavení regulačního rámce pro distributory. Řada distributorů není v Evropě registrována jako hospodářský subjekt, přesto prodávají vysoce rizikové nebo nevyhovující výrobky prostřednictvím přeshraničního online prodeje, a to i koncovým uživatelům bez odborné kvalifikace. Tento stav vytváří nerovné konkurenční prostředí pro výrobce dodržující předpisy a zároveň představuje potenciální ohrožení bezpečnosti pacientů.
„S úbytkem malých výrobců se snižuje i odolnost celého systému.“—Yvonne Hoffmann, Hoffmann Dental
Podle Yvonne Hoffmann čelí výrobci nepřiměřeným požadavkům na rozsah dokumentace a klinických studií. Rizika, která MDR představuje pro evropský dentální výrobní sektor, mají podle ní dvojí charakter: „Na jedné straně ztrácíme osvědčené a bezpečné zdravotnické prostředky, což v konečném důsledku ohrožuje bezpečnost pacientů. Současně se s úbytkem malých výrobců snižuje i odolnost celého systému.“ Ve zprávě rovněž zdůrazňuje, že rodinný podnik její rodiny přežil dvě světové války, řadu hospodářských krizí i pandemii COVID-19, „a nyní je akutně ohrožen požadavky MDR“.
Tři navrhovaná opatření ke zlepšení MDR
Autoři zprávy navrhují tři ad hoc opatření, která by bylo možné zavést relativně rychle a s minimálními náklady:
- Vytvoření nové kategorie „Class I Legacy“ pro zavedené technologie
Zdravotnické prostředky s minimálně desetiletou historií bezpečného používání podle původní směrnice o zdravotnických prostředcích (MDD) by byly přeřazeny do nové nízkorizikové třídy. Tyto výrobky by byly osvobozeny od nákladné přecertifikace notifikovanou osobou, avšak nadále by podléhaly důslednému dohledu po uvedení na trh ze strany národních orgánů.
- Proaktivní využívání článku 97 MDR ve prospěch menších podniků
Autoři vyzývají Evropskou komisi k umožnění výjimek podle článků 59 a 97 MDR s cílem prodloužit přechodné období pro menší výrobce se sídlem v EU, kteří vyrábějí bezpečné prostředky. Tento přístup by posílil roli národních zdravotnických autorit při zachování dostupnosti osvědčených výrobků během dokončování posuzování shody.
- Povinná registrace distributorů v evropské databázi zdravotnických prostředků
Všichni distributoři by měli být povinně registrováni v evropské databázi zdravotnických prostředků (EUDAMED) podle článku 31 MDR, obdobně jako výrobci a dovozci. Technicky by šlo pouze o zavedení nové identifikační řady, avšak tento krok by výrazně zlepšil sledovatelnost výrobků v přeshraničním elektronickém obchodě a omezil uvádění nebezpečných, nesprávně označených nebo necertifikovaných výrobků na trh.
Podle Hoffmann by koordinované úpravy MDR, zejména vytvoření samostatné kategorie pro dlouhodobě zavedené technologie, představovaly zásadní posun vpřed a mohly by evropský průmysl zdravotnických prostředků ochránit před nejistou budoucností. Závěrem zpráva konstatuje, že bez cílených a racionálních změn MDR hrozí Evropě ztráta inovativních rodinných výrobců i osvědčených materiálů, které tvoří základ každodenní stomatologické praxe.
Zpráva byla podpořena organizacemi The Association of Dental Dealers in Europe a Bundesverband Dentalhandel, německým svazem dentálních distributorů. Kopie dokumentu je dostupná online.
V současné době je naše psychika vystavena stále většímu a většímu náporu – ...
ČSK společně s dalšími dvěma sdruženími vydala prohlášení, ve kterém se vyjadřuje k aktuální situaci ve zdravotnictví. Zmiňují v něm ...
Vláda ČR 23. března jednomyslně schválila pozastavení elektronické evidence tržeb (EET), jejíž povinnost měla pro zdravotnické profese vstoupit ...
Po tříletém přechodném období a 12měsíčním odkladu z důvodu pandemie SARS-CoV-2 nyní začala v Evropské unii platit nová nařízení pro ...
Léčba průhlednými alignery není revoluce – je to evoluce!
Pro druhý kongres Evropské alignerové společnosti (EAS) si organizátoři vybrali ...
Rozhovor s ředitelem společnosti Petrem Švecem
Článek pojednává o přípravě a realizaci distanční výuky v oboru specializace Zubní technik – Fixní a snímatelné náhrady, z důvodu pandemie...
Letos v dubnu prodala zcela překvapivě německá skupina Heraeus zabývající se drahými kovy svoji dentální...
Je to už 12 let od chvíle, kdy Česká republika vstoupila do Evropské unie. Výhody jsou nezpochybnitelné – za tu ...
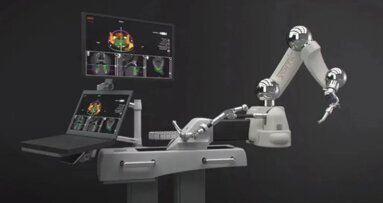
MIAMI, USA: Yomi je roboticky asistované chirurgické zařízení vyvinuté zdravotnickým startupem Neocis. Jedná se o jediný systém svého druhu, ...
Živý webinář
Čt. 29 ledna 2026
7:00 (CET) Prague
Živý webinář
Pá. 30 ledna 2026
2:00 (CET) Prague
Živý webinář
Pá. 30 ledna 2026
12:00 (CET) Prague
Dr. medic. stom. Henriette Lerner
Živý webinář
Pá. 30 ledna 2026
2:00 (CET) Prague
Univ.-Prof. Dr. Katrin Bekes MME
Živý webinář
Pá. 30 ledna 2026
3:00 (CET) Prague
Živý webinář
Pá. 30 ledna 2026
4:00 (CET) Prague
Prof. Dr. Falk Schwendicke MDPH
Živý webinář
Pá. 30 ledna 2026
5:00 (CET) Prague
Univ.-Prof. Dr. Katrin Bekes MME, Nikolai van Blericq, Prof. Dr. Falk Schwendicke MDPH



 Rakousko / Österreich
Rakousko / Österreich
 Bosna a Hercegovina / Босна и Херцеговина
Bosna a Hercegovina / Босна и Херцеговина
 Bulharsko / България
Bulharsko / България
 Chorvatsko / Hrvatska
Chorvatsko / Hrvatska
 Česká republika & Slovensko / Česká republika & Slovensko
Česká republika & Slovensko / Česká republika & Slovensko
 Francie / France
Francie / France
 Německo / Deutschland
Německo / Deutschland
 Řecko / ΕΛΛΑΔΑ
Řecko / ΕΛΛΑΔΑ
 Maďarsko / Hungary
Maďarsko / Hungary
 Itálie / Italia
Itálie / Italia
 Nizozemsko / Nederland
Nizozemsko / Nederland
 Severské země / Nordic
Severské země / Nordic
 Polsko / Polska
Polsko / Polska
 Portugalsko / Portugal
Portugalsko / Portugal
 Rumunsko a Moldavsko / România & Moldova
Rumunsko a Moldavsko / România & Moldova
 Slovinsko / Slovenija
Slovinsko / Slovenija
 Srbsko & Černá Hora / Србија и Црна Гора
Srbsko & Černá Hora / Србија и Црна Гора
 Španělsko / España
Španělsko / España
 Švýcarsko / Schweiz
Švýcarsko / Schweiz
 Turecko / Türkiye
Turecko / Türkiye
 Velká Británie & Irsko / UK & Ireland
Velká Británie & Irsko / UK & Ireland
 International / International
International / International
 Brazílie / Brasil
Brazílie / Brasil
 Kanada / Canada
Kanada / Canada
 Latinská Amerika / Latinoamérica
Latinská Amerika / Latinoamérica
 USA / USA
USA / USA
 Čína / 中国
Čína / 中国
 Indie / भारत गणराज्य
Indie / भारत गणराज्य
 Pákistán / Pākistān
Pákistán / Pākistān
 Vietnam / Việt Nam
Vietnam / Việt Nam
 ASEAN / ASEAN
ASEAN / ASEAN
 Izrael / מְדִינַת יִשְׂרָאֵל
Izrael / מְדִינַת יִשְׂרָאֵל
 Alžírsko, Maroko a Tunisko / الجزائر والمغرب وتونس
Alžírsko, Maroko a Tunisko / الجزائر والمغرب وتونس
 Blízký východ / Middle East
Blízký východ / Middle East









































To post a reply please login or register